Une approche de la psychopharmacologie des premiers épisodes psychotiques axée sur le rétablissement
Un article de
Laurent Béchard, PharmD, M. Sc., Candidat au Ph. D. en sciences pharmaceutiques: Faculté de pharmacie, Université Laval; Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale (Département clinique de pharmacie, Institut universitaire en santé mentale de Québec) ; Centre de recherche CERVO, Québec.
Olivier Corbeil, PharmD, M. Sc., Candidat au Ph. D. en sciences pharmaceutiques: Faculté de pharmacie, Université Laval; Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale (Département clinique de pharmacie, Institut universitaire en santé mentale de Québec) ; Centre de recherche CERVO, Québec.
Esthel Malenfant, BPharm, M. Sc., BCPP, Professeure de clinique, Faculté de pharmacie, Université Laval ; Centre intégré universitaire de santé et de services sociaux de la Capitale- Nationale (Département clinique de pharmacie, Institut universitaire en santé mentale de Québec), Québec.
Catherine Lehoux, Ph. D. et neuropsychologue, Centre intégré de santé et de services sociaux de Chaudière-Appalaches ; Centre de recherche CERVO, Québec.
Emmanuel Stip, MD Psychiatre, Professeur de psychiatrie, chef du département universi- taire, Université des Émirats arabes unis, Al-Aïn, EAU – Professeur émérite, Université de Montréal, Montréal.
Marc-André Roy, MD Psychiatre, M. Sc., FRCP, Professeur titulaire, Faculté de médecine, Université Laval; Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale (Institut universitaire en santé mentale de Québec); Centre de recherche CERVO, Québec.
Marie-France Demers, BPharm, M. Sc., BCPP, Professeure agrégée, Faculté de pharmacie, Université Laval ; Centre intégré universitaire de santé et de services sociaux de la Capitale- Nationale (Département clinique de pharmacie, Institut universitaire en santé mentale de Québec); Centre de recherche CERVO, Québec.
Paru dans Santé mentale au Québec, 2021, XLVI, no 2, aux pages 113 à 137.
Pour accéder à la revue complète : Premiers épisodes psychotiques : défis pratiques de l’intervention précoce
RÉSUMÉ Objectifs Les personnes composant avec un premier épisode psycho tique (PEP) sont peu représentées dans les essais cliniques menant à l’homologation des médicaments. En conséquence, il existe une relative pénurie de données empi riques pour guider le traitement psychopharmacologique de ces jeunes. Le présent article offre une synthèse de cette littérature, éclairée par l’expérience clinique de traitement des PEP acquise par les auteurs au cours des 25 dernières années.
Méthodes Cette revue sélective de la littérature porte sur le traitement psycho pharmacologique des PEP et inclut à la fois les essais randomisés et les études observationnelles. Elle s’organise autour des thèmes suivants concernant les PEP: les taux de réponse et de rémission ; les taux de rechute ; les spécificités relatives à la susceptibilité aux effets indésirables; les comparaisons entre les diverses molécules et formes pharmaceutiques en regard de l’efficacité, l’innocuité et la prévention de rechute; les recommandations quant à la durée du traitement; l’approche dans la résistance au traitement et l’utilisation de la clozapine. Pour chacun de ces thèmes, les données de recherche sont interprétées et complétées par des commentaires inspirés de l’expérience clinique des auteurs, dans une perspective résolument axée sur le rétablissement de la personne.
Résultats La rémission des symptômes est atteinte chez environ 75% des per sonnes lors du traitement initial d’un PEP, son maintien étant un très fort prédicteur du rétablissement fonctionnel. Les taux de rechute psychotique pendant les trois années suivant un PEP sont d’environ 60 %, le problème d’adhésion au traitement étant la principale cause de ces rechutes. La population PEP se distingue par une plus grande propension aux effets indésirables, notamment la prise de poids et les réactions extrapyramidales. À l’exception des PEP résistants au traitement, aucune différence claire n’a été démontrée quant à l’efficacité des agents antipsychotiques, mais ils se distinguent quant à leurs effets indésirables et leurs modalités d’admi nistration. À ce titre, l’utilisation des antipsychotiques à action prolongée (APAP) par voie intramusculaire injectable est supérieure aux agents par voie orale pour prévenir les rechutes. Si les lignes directrices recommandent le maintien du traite ment pour 18 mois suivant l’atteinte de la rémission, ces recommandations reposent sur des données empiriques encore imprécises, rendant nécessaire le recours à une approche de décision partagée sur cette question. Dans le groupe des personnes n’obtenant pas une réponse satisfaisante après 2 essais d’antipsychotiques, la clozapine est efficace chez jusqu’à 80% des personnes.
Conclusions La population PEP se distingue par un taux élevé de réponse, des rechutes fréquemment liées à la nonadhésion au traitement et une sensibilité accrue aux effets indésirables. L’ajustement personnalisé du traitement pharmaco logique des PEP vise la rémission soutenue de toutes les dimensions des symptômes alliée à une gestion proactive des effets indésirables, y compris à travers une utilisation judicieuse des APAP et de la clozapine.
MOTS CLÉS psychopharmacologie, antipsychotiques, premier épisode psycho tique, clozapine, antipsychotique injectable à action prolongée, rétablissement
Objectifs
Les personnes composant avec un premier épisode psychotique (PEP) sont peu représentées dans les essais cliniques randomisés (ECR) menant à l’homologation des médicaments (Huhn et coll., 2019). En conséquence, il existe une relative pénurie de données empiriques pour guider le traitement psychopharmacologique de ces jeunes. Qui plus est, les ECR mettent l’accent sur l’efficacité en phase aiguë, plutôt que sur le bien-être, les aspects fonctionnels et le devenir à plus long terme (Awad, 2021). Ainsi, ce qui doit être visé n’est pas seulement la réponse clinique au traitement, mais plus largement, l’efficience clinique. Cette dernière ne se définit plus exclusivement en termes d’efficacité sur les symptômes positifs, négatifs et de désorganisation, mais correspond plutôt à l’atteinte d’un équilibre entre les effets bénéfiques des médicaments et leurs effets indésirables, en soutien au rétablissement fonctionnel et à l’atteinte d’une qualité de vie satisfaisante pour la personne.
Le présent article offre une synthèse de cette littérature, éclairée par l’expérience clinique de traitement des PEP acquise par les auteurs au cours de près de 25 années.
Méthodes
Cette revue sélective de la littérature porte sur le traitement psy- chopharmacologique des PEP et inclut à la fois les ECR et les études observationnelles. Les références ont été identifiées en fonction d’une surveillance continue de la littérature par les auteurs, enrichie par une mise à jour effectuée en mars 2021 utilisant la base de données MEDLINE à l’aide de mots-clés spécifiques à la psychopharmacologie des PEP (First-episode psychosis ; pharmacological treatment ; antipsychotics). Cette revue s’organise autour des thèmes suivants concernant les PEP: les taux de réponse et de rémission; les taux de rechute; les spécificités relatives à la susceptibilité aux effets indésirables; les comparaisons entre les diverses molécules et formes pharmaceutiques en regard de l’efficacité, l’innocuité et la prévention de rechute; les recommandations quant à la durée du traitement; l’approche dans la résistance au traitement et l’utilisation de la clozapine. Pour chacun de ces thèmes, les données de recherche sont interprétées et complétées par des commentaires inspirés de l’expérience clinique des auteurs.
Résultats
Taux de réponse et de rémission
La rémission des symptômes est atteinte chez environ 75% des personnes lors du traitement initial d’un PEP, son maintien étant un très fort prédicteur du rétablissement fonctionnel (Zhu et coll., 2017). Cette estimation peut varier en fonction des critères de réponse utilisés et de la période d’observation, référant, par exemple, à une réduction (en%) depuis le score initial des symptômes ou encore selon l’atteinte d’un seuil établi de non-sévérité de la maladie ; la rémission est alors définie selon certains critères basés sur des échelles de psychopathologie reconnues, notamment les critères d’Andreasen et coll. (Andreasen et coll., 2005; Jordan et coll., 2014). Ce taux de réponse est plus élevé, et plus rapide, que celui rapporté dans les ECR réalisés dans des popu- lations autres que les PEP, démontrant que ces personnes présentent une meilleure réponse au traitement que les personnes traitées depuis plus longtemps et ayant traversé plus d’épisodes psychotiques. De plus, de façon générale, les doses antipsychotiques requises chez les PEP pour atteindre ces taux de réponse sont plus faibles que celles utilisées chez des patients ayant un plus long cours de la maladie (Keating et coll., 2021). Au-delà du contrôle des symptômes positifs, négatifs et de désorganisation, l’atteinte et le maintien de la rémission constituent la cible à viser pour maximiser les chances de rétablissement fonctionnel et assurer une qualité de vie satisfaisante (Andreasen et coll., 2005).
Au plan clinique, l’utilisation d’échelles validées permettant d’ob- jectiver la réponse au traitement constitue une pratique à privilégier. En effet, la réponse au traitement n’est pas un phénomène de tout ou rien, et il est donc important de détecter des améliorations plus subtiles, car elles peuvent annoncer une amélioration qui surviendra avec le main- tien du traitement. Différents outils comme la PANSS (Positive and Negative Syndrome Scale) (Kay, Fiszbein et Opler, 1987), ou la PSYRATS (Psychotic Symptoms Rating Scale) (Haddock, McCarron, Tarrier et Faragher, 1999) permettent d’évaluer la progression vers la rémission. Ainsi, inspiré de la PSYRATS, le clinicien saura tirer profit de questions ouvertes qui mettent bien en exergue l’amorce d’une réponse au trai- tement (Drake, Haddock, Tarrier, Bentall et Lewis, 2007). L’encadré 1 présente quelques questions inspirées de cet instrument.
Exemples de questions inspirées de l’Échelle PSYRATS
Haddock, G., McCarron, J., Tarrier, N. et Faragher, E. B. (1999). Scales to measure dimensions of hallucinations and delusions: the psychotic symptom rating scales (PSYRATS). Psychol Med, 29(4) : 879-889. doi: 10.1017/s0033291799008661
- Depuis que vous prenez ce médicament, est-ce que l’intensité sonore des voix que vous percevez a changé ? Est-ce que leur contenu est moins dérangeant ?
- À quelle fréquence ces voix surviennent-elles? Y a-t-il des moments dans la journée où elles sont davantage présentes ?
- Quel pourcentage du temps ces voix vous importunent-elles? Est-ce que vous percevez un changement sur cette proportion depuis que vous prenez ce médicament ?
- D’où proviennent ces voix à votre avis? Est-ce qu’elles sont produites par votre cerveau ou elles viennent plutôt de l’extérieur de votre tête ? Quel est votre niveau de conviction de l’origine de ces voix ? Qu’avez-vous envisagé pour y remédier ?
La rechute, un phénomène omniprésent
Les taux de rechute psychotique pendant les 3 années suivant un PEP sont d’environ 60% et le problème d’adhésion au traitement en est la principale cause (Kishi et coll., 2019). En effet, un arrêt de traitement augmente de 4 à 5 fois le risque d’une rechute (Robinson et coll., 1999). La consommation de substances constitue l’un des facteurs de risque les plus associés à la non-adhésion au traitement en plus d’être, indé- pendamment de la prise ou non du médicament, un facteur contribuant à la rechute. Parmi les autres facteurs reconnus, on compte notamment la non-reconnaissance de la maladie, les craintes et la stigmatisation reliées à l’usage des médicaments ainsi que les schémas posologiques complexes (Velligan, Sajatovic, Hatch, Kramata et Docherty, 2017). La prévention de la rechute doit être une cible majeure du traitement, car chaque rechute nuit au rétablissement et contribue à augmenter la dangerosité du patient, et la réponse au traitement s’émousse progres- sivement au fil des rechutes (Takeuchi et coll., 2019; Witt, van Dorn et Fazel, 2013). C’est pour cela qu’on ne doit pas banaliser la rechute en la concevant comme étant inéluctable ou en la considérant comme étant une expérience nécessaire au développement de l’autocritique. Ainsi, l’intervenant PEP aura intérêt à bien posséder les techniques de dépistage de la non-adhésion au traitement et de consommation de substances. L’encadré 2 réfère à des exemples de questions inspirées des travaux de Shawn Shea (Shea, 2017).
Exemples de questions pour évaluer l’adhésion au traitement ou de consommation de substances inspirées des travaux de S. C. Shea Shea, S. C. (2017). Psychiatric interviewing, 3rd Edition. The art of understanding : a practical guide for psychiatrists, psychologists, counselors, social workers, nurses and other mental health professionals. Elsevier.
Une sensibilité accrue à certains effets indésirables
La population PEP se distingue par une plus grande sensibilité à cer- tains effets indésirables.
Les troubles du mouvement
Les réactions extrapyramidales sont particulièrement fréquentes chez les jeunes, y compris en présence des antipsychotiques de seconde génération (ASG) et de troisième génération (Carbon et coll., 2015; Garcia-Amador et coll., 2015). Pour cette raison notamment, toutes les lignes directrices privilégient ces nouveaux antipsychotiques plutôt que ceux de première génération comme option initiale de traitement phar- macologique (Crockford et Addington, 2017 ; Galletly et coll., 2016). Les manifestations extrapyramidales associées aux ASG et de troisième génération (antipsychotiques à effet agoniste dopaminergique) sont moins faciles à mettre en évidence, notamment parce que les instruments pour les détecter ont été développés pour les antipsychotiques de première génération et donc, manquent de sensibilité pour reconnaître des effets plus subtils. Or, ces manifestations demeurent présentes et invalidantes, notamment parce qu’elles peuvent affecter la cognition (Potvin, Aubin et Stip, 2015), et ainsi nuire au rétablissement, et susciter de la stigmatisation (Haddad, Das, Keyhani et Chaudhry, 2012). L’impact négatif de ces effets indésirables sur l’adhésion au traitement, même à long terme après une manifestation extrapyramidale aiguë (p. ex. une dystonie survenue suivant une injection intramusculaire d’halopéridol en contexte d’urgence), a aussi été clairement démontré (Lambert et coll., 2004).
Ces manifestations prennent différentes formes dont l’impatience motrice (ou akathisie), le ralentissement psychomoteur, y compris la bradyphrénie (ralentissement de la pensée), les crampes au niveau du visage et du tronc, une réduction de l’expression du visage, une prosodie altérée, une gamme émotionnelle réduite, et un aspect global figé. Elles varient selon les antipsychotiques utilisés (plus fréquentes avec les agents plus incisifs de type rispéridone, palipéridone) (Huhn et coll., 2019), les doses utilisées, la combinaison avec d’autres médicaments (antidépresseurs, lithium, bloquants des canaux calciques notamment) et elles peuvent fluctuer en fonction du moment de prise, survenant parfois seulement au moment où les concentrations sanguines atteignent leur maximum (y compris selon le cycle d’administration des anti- psychotiques à action prolongée par voie intramusculaire injectable [APAP]). Elles sont notamment majorées par la prise de stimulants (caféine, amphétamines), et aussi par celle de cannabis et d’alcool (Procyshyn, 2019). Parmi les autres facteurs de risque reconnus, on compte le fait de provenir des ethnies plus à risque comme les personnes noires, asiatiques et celles des Premières Nations (Ormerod, McDowell, Coleman et Ferner, 2008), le fait d’avoir subi des traumatismes crâniens ou de présenter des maladies cérébrales organiques (Procyshyn, 2019).
Par ailleurs, le recours à l’utilisation de correcteurs tels que les benzodiazépines et les anticholinergiques peut induire des difficultés cognitives significatives, qui constitueront un autre obstacle au rétablissement. Utiles pour contrer une manifestation indésirable aiguë (dystonie, akathisie), ces agents ne devraient pas être utilisés au long cours chez les PEP et devraient faire l’objet d’une réévaluation systéma- tique rapide (Chong, Ravichandran, Poon, Soo et Verma, 2006). Ainsi, plutôt que d’ajouter de tels médicaments, on essaiera de prévenir ces effets par des modifications de traitement appropriées, par exemple par la diminution de la dose de l’antipsychotique ou le passage à une molécule moins à risque de causer de tels effets.
Algorithme de détection et d’intervention pour contrer les symptômes négatifs
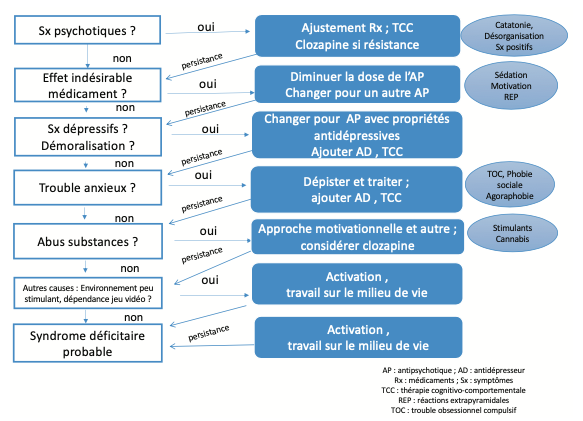
Il peut être difficile de distinguer ces effets indésirables des symp- tômes négatifs primaires ou des signes de dépression. À cet égard, Carpenter, Heinrichs et Alphs (1985) ont proposé une démarche systématique d’évaluation des causes liées à la présence de symptômes négatifs, dont justement les effets extrapyramidaux associés aux psychotropes. L’encadré 3 présente une adaptation très clinique de cet algorithme, qui inclut la suggestion d’interventions spécifiques pour tenter de remédier aux symptômes négatifs, dont une revue attentive des effets indésirables de l’antipsychotique, dont le ralentissement psychomoteur et des effets au plan subjectif.
La dysphorie aux neuroleptiques
Les PEP décrivent souvent comme effet indésirable parmi les plus dérangeants, une impression d’être «déconnecté de leurs émotions, de se sentir zombie », et ce, dès l’instauration du traitement antipsychotique.
La dysphorie aux neuroleptiques est un phénomène sous-estimé en clinique, dont les preuves empiriques reposent notamment sur une corrélation claire entre le blocage dopaminergique et une impression subjective négative du traitement (Mizrahi et coll., 2007). Souvent associée à des troubles du mouvement, elle peut aussi se manifester d’une façon insidieuse et indépendante (Wu et Okusaga, 2015). Cette dysphorie peut contribuer à la non-adhésion au traitement, favoriser la consommation de substances, de là, entraîner une cascade médicamenteuse qui finit par nuire plutôt qu’aider: la personne se sent mal; prend partiellement ses antipsychotiques; consomme des substances; devient plus symptomatique sur le plan de la psychose et voit ainsi ses antipsychotiques majorés, alors que de façon contre-intuitive une diminution de dose ou un changement vers un agent qui bloque moins les voies dopaminergiques pourrait mieux convenir et favoriser l’engagement de la personne dans son traitement.
Les perturbations métaboliques et la prise de poids
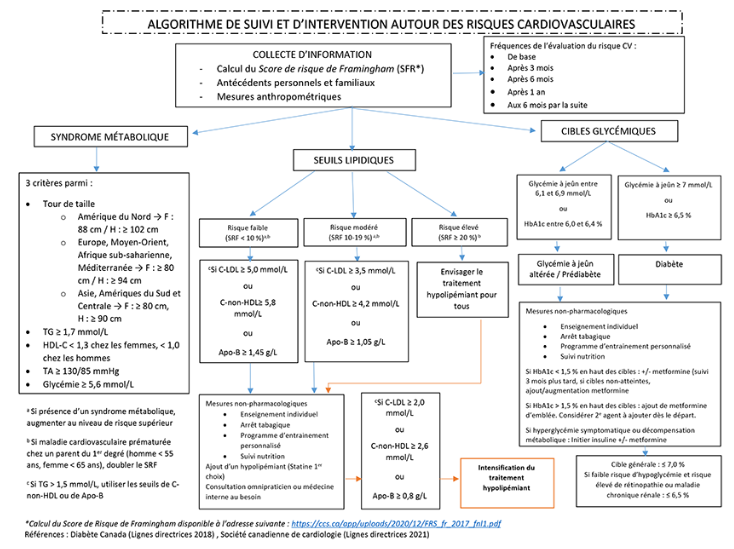
Les prises de poids évaluées en PEP sont nettement supérieures et se développent plus rapidement (dès les premières semaines) que celles observées dans les autres populations susceptibles de recevoir des antipsychotiques (Alvarez-Jimenez et coll., 2008). Elles conduisent à plusieurs complications telles l’obésité, la dyslipidémie, la résistance à l’insuline, l’hypertension artérielle, le développement d’un syndrome métabolique et même le diabète (Curtis et coll., 2016). En fait, les individus atteints d’un trouble psychotique seraient à priori, avant même l’exposition aux traitements pharmacologiques, plus à risque de développer ces problèmes de santé, expliquant en partie la mortalité précoce observée dans ce groupe d’individus (Frajerman, Morin, Chaumette, Kebir et Krebs, 2020; Teff et coll., 2013). Eu égard aux impacts à long terme de ces problèmes, il est généralement conseillé d’essayer d’éviter l’utilisation à long terme de l’olanzapine, la molécule ayant le plus grand impact sur cet aspect (considérant son profil d’efficacité, somme toute comparable à celle des autres antipsychotiques, hormis la clozapine). Ceci dit, tous les antipsychotiques utilisés chez les PEP sont susceptibles d’engendrer ces complications, y compris les antipsychotiques souvent considérés comme plus neutres à cet égard comme les agents de troisième génération, et conséquemment, un monitorage étroit est requis, peu importe l’antipsychotique utilisé, et ce, même si l’ampleur de la prise de poids et des perturbations métaboliques peut différer selon les agents (Barton, Segger, Fischer, Obermeier et Musil, 2020 ; Gomez-Revuelta et coll., 2018). Par exemple, une récente étude réalisée chez des PEP montre que l’utilisation de l’un ou l’autre des deux APAP les plus fréquemment prescrits (aripiprazole et palipéridone) chez les PEP entraîne des prises de poids similaires à un an, avec une surreprésentation de jeunes considérés en surpoids ou obèses, passant de 33 % à 60 % (Shymko et coll., 2021). Une évaluation des facteurs de risque cardiovasculaires qui inclut notamment une histoire d’obésité, de problèmes cardiovasculaires, de diabète, une suspicion d’apnée du sommeil (souvent sous-estimée en clinique) doit s’accompagner d’une revue des antécédents familiaux de maladie cardiovasculaire et de diabète et doit être considérée dans le choix de traitement du PEP. Certaines données montrent que ces risques sont souvent sous-estimés chez les PEP, justement parce qu’ils sont jeunes. Des stratégies proactives de prévention de prise de poids et de promotion de saines habitudes de vie, y compris la diète et l’exercice, sont reconnues efficaces pour réduire ces risques (Edelsohn, 2019). L’encadré 4 présente l’algorithme de suivi et d’intervention en vigueur à la Clinique Notre-Dame des Victoires (Brunham et coll., 2018 ; Ivers et coll., 2019).
Algorithme de suivi et d’intervention en lien avec le risque cardiovasculaire
Certains effets indésirables plus dérangeants
Les troubles de la fonction sexuelle sont fréquents chez les PEP et peuvent être associés ou non à l’hyperprolactinémie, particulièrement en présence de certains ASG (notamment rispéridone/palipéridone) ou de ceux de première génération. Cette hyperprolactinémie, plus prononcée chez la femme, est pourtant mieux corrélée avec des répercussions cliniques dérangeantes chez l’homme, même en présence d’une faible augmentation, et constitue, dans les deux cas, une menace à l’adhésion au traitement, particulièrement chez les PEP (Grigg et coll., 2017). Ainsi, les hommes peuvent décrire des troubles de la fonction érectile et parfois, des picotements au niveau des mamelons, alors que chez les femmes, les irrégularités menstruelles et la galactorrhée peuvent survenir. Le suivi du calendrier des menstruations est judicieux chez ces dernières. Compte tenu du caractère souvent perçu comme embarrassant par les PEP des conversations autour de ces effets indésirables, les troubles de la fonction sexuelle ne sont souvent pas rapportés de façon spontanée. Or, puisqu’ils sont une cause fréquente de remise en question de la poursuite du traitement, un questionnaire spécifique, qui inclut la revue des attentes du jeune en matière de fonctionnement sexuel, permet de mieux isoler les impacts liés au traitement pharmacologique, et de les différencier de dysfonctions dues à des facteurs psychologiques. Il existe différents questionnaires valides et spécifiques aux effets indésirables sexuels des psychotropes, pour mieux objectiver ces difficultés, notamment l’Arizona Sexual Experience Scale disponible en français (Briki et coll., 2014). En particulier, l’absence d’érections nocturnes peut constituer un indice d’une origine médicamenteuse probable chez l’homme. Plusieurs solutions peuvent être envisagées, le cas échéant, y compris une diminution de dose, un changement d’antipsychotique ou l’ajout d’un antipsychotique agoniste dopaminergique. En présence d’hyperprolactinémie, l’ajout de carbergoline (un agoniste dopaminergique) est aussi décrit.
Finalement, chez les hommes, bien que non remboursé par la RAMQ (Régie de l’assurance maladie du Québec [Au Québec, la Régie de l’assurance maladie du Québec (RAMQ) administre le régime public d’assurances médicaments, dont bénéficie une majorité de FEP. La liste de médicaments et les conditions de couverture sont déterminées par la RAMQ.]), l’usage ponctuel d’agents de type sildénafil/tadalafil peut contribuer à faire en sorte que le jeune regagne confiance et retrouve un fonctionnement sexuel satisfaisant, particulièrement lorsque l’origine des dysfonctions semble mixte. Des complications à long terme, dont la survenue d’ostéoporose, mais aussi l’augmentation potentielle du risque de cancer du sein chez les femmes avec hyperprolactinémie soutenue (≥ 5 ans, effet cumulatif), sont particulièrement préoccupantes chez les PEP compte tenu de la durée d’exposition de traitement anticipée, et devraient faire partie des éléments à considérer lors du choix de traitement (Lally et coll., 2017 ; Taipale, 2021). Finalement, chez les femmes, le désir de procréer et les impacts des médicaments sur la fertilité doivent faire l’objet d’une attention particulière.
L’hypotension peut constituer un frein à l’ajustement de certains médicaments, particulièrement chez les jeunes filles (sur la base d’observations cliniques). Outre les mesures non pharmacologiques (hydratation, bas de contention), l’ajout de correcteurs (p. ex. capsules de chlorure de sodium, fludrocortisone, midodrine) peut être envisagé.
La constipation, la sédation et la fatigue sont aussi des problèmes fréquents, qui méritent une approche proactive et pour lesquels des solutions existent. La revue minutieuse des médicaments au profil (y compris la médication physique ou prise en vente libre), l’ajustement, le fractionnement ou le regroupement des doses des psychotropes, le recours à des formulations courte action (quétiapine IR plutôt que XR, p. ex. pour limiter la somnolence diurne résiduelle), l’ajout de correc- teurs (p. ex. laxatifs) ou encore le changement de l’antipsychotique doivent être alors considérés (Procyshyn, 2019).
L’encadré 5 présente un tableau qui résume l’impact des antipsycho- tiques en lien avec différents effets indésirables parmi les plus fréquents ou qui devraient faire l’objet d’une attention particulière (Taylor, Paton et Kapur, 2015).
Principaux effets indésirables à surveiller et particularités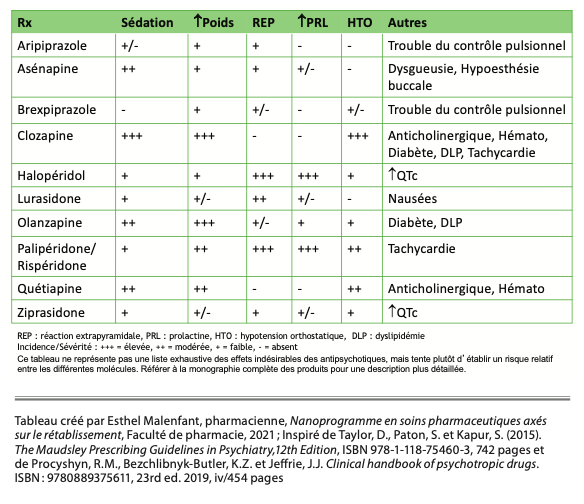
Différences entre les molécules en phase aiguë
À l’exception des PEP présentant une résistance au traitement, aucune différence claire n’a été démontrée quant à l’efficacité des diverses molécules, mais elles se distinguent toutefois en ce qui concerne les effets indésirables et les modalités d’administration (Huhn et coll., 2019). La présentation des manifestations psychotiques initiales et la présence de comorbidités seront prises en compte dans le choix du traitement antipsychotique. Parmi les antipsychotiques disponibles, l’accès à une forme injectable à longue action et les distinctions dans la propension à induire des manifestations extrapyramidales, des dysfonctions sexuelles ou de la prise de poids et des perturbations métaboliques seront souvent cités comme des éléments clefs dans le choix de traitement pour un individu donné (voir encadré 5).
APAP et prévention de la rechute
Tel que mentionné précédemment, l’adhésion au traitement constitue un enjeu majeur du traitement pharmacologique des PEP. Différentes stratégies peuvent être mises de l’avant pour soutenir la poursuite du traitement, dont l’utilisation proactive des APAP (Stip et coll., 2020). En général, les ECR ont révélé peu de différence entre les antipsychotiques administrés par voie orale et les APAP dans la prévention de rechute, alors que les études miroir ont démontré une plus grande efficacité associée à ces derniers (Kishimoto, Nitta, Borenstein, Kane et Correll, 2013 ; Kishimoto et coll., 2014). Les experts expliquent ces différences par des considérations méthodologiques, notamment par le biais intro- duit dans les ECR lié à l’exclusion des patients qui bénéficient le plus des APAP, comme les patients sous ordonnance de soins ou ceux avec des troubles d’utilisation de substances (Kirson et coll., 2013).
Les données quant à la supériorité des APAP en PEP, bien que basées sur un petit nombre d’études, sont particulièrement élo- quentes. Premièrement, une étude panpopulationnelle, donc sans biais d’échantillonnage (Tiihonen et coll., 2011), réalisée en Finlande à partir d’imposants registres, révèle qu’après une première hospitalisation en psychiatrie, le risque de rechute est 3 fois moins élevé lorsque la per- sonne est sous antipsychotique injectable que lorsqu’elle prend la même molécule par voie orale à sa sortie d’hôpital. Deuxièmement, une autre étude réalisée auprès de 83 patients exposés à la rispéridone en début d’évolution d’une schizophrénie révèle que le taux de rechute à un an est de 50 % sous cet antipsychotique pris par voie orale alors qu’il est de moins de 10% lorsque pris sous sa forme injectable (Subotnik et coll., 2015). Finalement, l’utilisation d’un APAP a produit une réduction de 44% du taux d’incidence des premières hospitalisations par rapport à l’utilisation d’antipsychotiques administrés de manière conventionnelle. Selon l’équipe qui a rapporté ces résultats, pour 7 patients traités avec un APAP, une hospitalisation a été évitée, en moyenne (Kane et coll., 2020).
Ces données ont mené un groupe d’experts mandatés par l’Asso- ciation des médecins psychiatres du Québec (AMPQ) à recommander l’offre systématique des APAP dès le PEP (Stip et coll., 2020), ce qui va à l’encontre des pratiques habituelles de n’introduire un APAP qu’après plusieurs rechutes, pratique qui mène à leur sous-utilisation. Plusieurs barrières à l’utilisation systématique des APAP sont décrites et elles diffèrent selon les perspectives du patient, du clinicien ou encore sont liées à l’organisation des soins (Iyer et coll., 2013a, 2013b ; Lindenmayer, Glick, Talreja et Underriner, 2020). Notamment, une analyse du dis- cours des médecins effectuée dans une étude qualitative met en lumière l’importance de la mise de l’avant d’arguments positifs envers les APAP dans l’acceptation par les patients (Weiden et coll., 2015).
Les avantages au plan économique sont aussi décrits. En utilisant les données de la RAMQ, l’impact des APAP a été évalué sur l’utilisation des ressources de soins de santé (Health Care Resource Utilization, [HCRU]) dans différents groupes d’âge de patients atteints de schizophrénie. Le HCRU et les coûts associés ont été analysés au cours de l’année avant et après le début de l’APAP, en utilisant 5 groupes d’âge: < 30, 30-39, 40-49, 50-59 et ≥ 60 ans. L’étude a inclus 1996 personnes atteintes de schizophrénie et leur âge moyen était de 43,4 ans (écart-type : 14,5). Des réductions similaires des jours d’hospitalisation et des coûts totaux du HCRU ont été observées dans tous les groupes d’âge. En ce qui concerne les PEP, au cours de la période précédant l’initiation, les coûts moyens associés au HCRU total étaient plus élevés chez les patients de moins de 25 ans (64263 $) que chez ceux âgés de 25 ans et plus (57108 $) (P ≤ 0,01), et ce montant baissait respectivement à 32 830 $ et 23 412 $ dans l’année qui suivait la prescription de l’APAP (Stip, 2017).
Combien de temps maintenir l’antipsychotique ?
Plusieurs lignes directrices recommandent le maintien du traitement pharmacologique pendant au moins 12 à 18 mois après l’atteinte de la rémission. Cette durée précise revêt un caractère arbitraire vu l’absence d’études comparant les impacts d’autres délais avant la ten- tative d’arrêt. Ce débat perdure notamment à la suite des travaux de Wunderink (2013) où une portion plus importante de PEP ayant cessé précocement les antipsychotiques a atteint le seuil de la rémission fonctionnelle à long terme (ce qui n’est pas sans refléter le fardeau des effets indésirables discuté précédemment). Cette question fait actuel- lement l’objet d’une évaluation longitudinale d’envergure (Begemann et coll., 2020). Quoi qu’il en soit, une conclusion importante de cette controverse — et qui est aussi une recommandation de la plupart des lignes directrices en vigueur — est la nécessité d’adopter une approche qui inclut la décision partagée autour du choix de maintenir ou non le traitement pharmacologique avec la personne et ses proches. Or, mal- heureusement, il n’existe pas d’outils d’aide à la décision partagée pour soutenir ce dialogue spécifique au PEP. Les facteurs pouvant justifier l’intérêt d’un maintien à plus long terme incluent la persistance d’une consommation de drogues, la dangerosité lors d’épisodes psychotiques précédents ou un diagnostic sans équivoque de schizophrénie plutôt, par exemple, que de psychose induite. En pratique, dans la majorité des cas, les personnes voudront faire l’expérience d’une telle cessation de la médication. Dans de tels cas, il est recommandé de procéder très graduellement et d’établir un solide filet de sécurité (Addington et coll., 2016).
Résistance au traitement
Il est estimé qu’environ 20 % des PEP ne présenteront pas une réponse satisfaisante à 2 essais consécutifs d’antipsychotiques, rencontrant ainsi le critère de résistance au traitement (Agid et coll., 2011). On a proposé qu’il puisse s’agir d’un sous-type distinct de la maladie, qui présente une pathophysiologie autre qu’une augmentation de l’activité dopaminergique, notamment au plan glutamatergique. Les jeunes hommes ayant connu leur premier épisode avant l’âge de 20 ans seraient notamment plus à risque (Lally et Gaughran, 2019). En plus de ces cas, qu’on qualifie de résistance primaire, d’autres développeront une résistance secondaire, c’est-à-dire une résistance qui apparaîtra à la faveur d’une rechute subséquente (Takeuchi et coll., 2019). La défini- tion des formes de résistance au traitement est plus complexe en PEP, car la plus grande propension à développer des effets indésirables, en particulier extrapyramidaux, peut empêcher l’atteinte des doses maxi- males recommandées. Aussi, cette résistance au traitement doit être distinguée d’une pseudo-résistance, issue de résultats insatisfaisants dus à un problème d’adhésion au traitement. Ceci a mené des experts à recommander l’utilisation d’un APAP avant de conclure à une résis- tance au traitement (Stip, Abdel-Baki, Roy, Bloom et Grignon, 2019).
La place de la clozapine
La clozapine a longtemps été perçue comme une option de dernier recours dans le traitement des troubles psychotiques, entre autres puisque l’on craint particulièrement les problèmes hématologiques qui peuvent y être associés. Or, lorsqu’utilisée rapidement dès l’atteinte du critère de résistance au traitement, elle aurait une efficacité d’autant plus élevée et avantageuse. Agid et collaborateurs (2011) ont testé l’algorithme suivant dans le traitement des PEP chez 327 patients: les patients recevaient d’abord l’olanzapine ou la rispéridone, puis ils étaient soumis à l’autre de ces molécules dans le cas où la première ne fonctionnait pas. Le taux de réponse, initialement de 75,4% pour la première molécule utilisée, chutait à 16,7 % pour la deuxième molécule utilisée. Enfin, l’algorithme prévoyait un dernier essai, à la clozapine cette fois, pour les patients n’ayant pas répondu aux 2 premières molécules. Le taux de réponse à la clozapine, chez ces patients (n = 28), s’est avéré de 75%, contre 0% pour ceux qui ont poursuivi avec la même molécule (n = 22) (Agid et coll., 2011). Cependant, les rares études réalisées avec la clozapine comme traitement de première intention lors du PEP ne justifient pas une telle utilisation. En plus d’un taux de réponse particulièrement élevé lorsqu’utilisée rapidement une fois le critère de résistance démontré, l’utilisation de la clozapine est associée à une panoplie d’avantages cliniques tels qu’une efficacité supérieure pour les symptômes positifs, des avantages possibles pour les symptômes négatifs, une quasi-absence d’effets indésirables extrapyramidaux ou de dyskinésie tardive, des avantages liés à la réduction de l’hostilité et de la violence, la prévention du suicide chez les patients atteints de schizophrénie à risque élevé et de troubles schizoaffectifs, une possibilité de réduction de la toxicomanie alcool et cannabis, un taux de mortalité inférieur comparativement à d’autres antipsychotiques, une durée d’hospitalisation plus courte et une plus grande adhésion au traitement. Il est possible que les contacts réguliers avec le personnel soignant, en raison du suivi hématologique inhérent à l’utilisation de la clozapine, expliquent une partie de ces résultats. Quoi qu’il en soit, les perceptions erronées des effets de la clozapine mènent à une sous-utilisation de cette molécule en intervention précoce et dans le traitement des psychoses en général (Williams et coll., 2017).
Une étude récente rapporte que 19,7% des PEP de 3 cliniques d’intervention précoce au Canada ont reçu la clozapine, en moyenne après 2,4 essais, après une durée d’exposition à un antipsychotique de 471 jours. De cette proportion, 69% d’entre eux ont atteint une rémission fonctionnelle, et ce, malgré le fait que plusieurs présentaient initialement des barrières à l’utilisation de la clozapine. En effet, ces jeunes étaient 2 fois plus à risque que les autres patients (sans clo- zapine) d’être sous autorisation de soins, présentaient 2,65 fois plus de troubles d’utilisation de substances et 4 fois plus de troubles de la personnalité (Leclerc et coll., 2021).
Les conditions gagnantes pour réduire les barrières à l’utilisation de la clozapine passent d’abord par une démystification de ce psycho- trope. À cet effet, le Guide d’utilisation de la clozapine, élaboré par les pharmaciens du Département clinique de pharmacie du Centre intégré universitaire de santé et de services sociaux (CIUSSS) de la Capitale-Nationale, est un outil complet et pratico-pratique apprécié en clinique. L’utilisation efficace de la clozapine passe également par un suivi étroit des effets indésirables qui y sont associés, le plus souvent la constipation, l’énurésie, l’hypersalivation et la prise de poids, bien plus encore que les problèmes hématologiques souvent craints. Bien sûr, une approche de collaboration interprofessionnelle peut mieux soutenir les défis associés à la prise et au maintien de la clozapine chez les PEP (CIUSSS de la Captitale-Nationale, 2019).
Conclusions
Le choix du médicament, l’identification des cibles de traitement et de sa durée doivent se faire en équipe avec le patient, en considérant des enjeux aussi diversifiés que l’incertitude diagnostique, la sévérité du PEP, la capacité du patient à reconnaître ses symptômes, les effets indésirables médicamenteux potentiels et l’importance accordée par le patient à chacun d’eux, la complexité posologique, les exigences du monitorage, l’implication de la famille et surtout, le projet de vie de la personne.
Dans le traitement des troubles psychotiques, comme dans bien d’autres domaines en santé, chaque patient est une expérience unique avec un n égal à 1. En ce sens, l’utilisation d’échelles cliniques validées est à encourager, de façon à évaluer de manière rigoureuse les effets indésirables de même que l’efficacité des traitements. Le recueil sys- tématique des données cliniques permet un suivi exhaustif où rien n’est laissé au hasard. On s’assure ainsi que le médicament demeure au service du rétablissement de la personne.
L’adhésion au traitement représente un enjeu majeur en santé men- tale, particulièrement chez les PEP. Comment pourrait-on reprocher à un jeune de 20 ans de ne pas vouloir prendre un médicament pour une condition dont il considère parfois ne pas souffrir ? Quel serait pour lui le bénéfice de recevoir un médicament qui supprimerait les symptômes psychotiques, mais qui nécessiterait l’utilisation d’agents correcteurs pour réduire les effets indésirables extrapyramidaux, lesquels auraient pour conséquence de le rendre incapable de se concentrer, d’encoder de nouvelles informations, de fonctionner, un médicament qui le ralentirait, le rendrait dysphorique et stigmatisé par les manifesta- tions visibles de son utilisation ? Ou encore qui lui occasionnerait des complications à long terme et affecterait sa qualité de vie et même son espérance de vie? La perspective du rétablissement suppose une utilisation du médicament qui soit au service de la qualité de vie et de la satisfaction globale du patient. L’efficacité, mais également le confort, doivent constituer des cibles du traitement. L’engagement du patient et de sa famille dans les choix qui guident l’ajustement des médicaments est un impératif et s’inscrit dans la philosophie de traitement des PEP. Finalement, l’ajustement proactif et personnalisé du traitement pharmacologique doit être au service du projet de vie de la personne; l’approche pharmacologique doit en tout temps constituer une alliée au rétablissement de la personne et non un obstacle.
Références
Addington, D. E., Norman, R., Bond, G. R., Sale, T., Melton, R., McKenzie, E. et Wang, J. (2016). Development and Testing of the First-Episode Psychosis Services Fidelity Scale. Psychiatr Serv, 67(9), 1023-1025. doi:10.1176/appi.ps .201 500 398
Agid, O., Arenovich, T., Sajeev, G., Zipursky, R. B., Kapur, S., Foussias, G. et Remington, G. (2011). An algorithm-based approach to first-episode schi- zophrenia: response rates over 3 prospective antipsychotic trials with a retrospective data analysis. J Clin Psychiatry, 72 (11), 1439-1444. doi:10.4088/ JCP.09m05785yel
Alvarez-Jimenez, M., Gonzalez-Blanch, C., Crespo-Facorro, B., Hetrick, S., Rodriguez-Sanchez, J. M., Perez-Iglesias, R. et Vazquez-Barquero, J. L. (2008). Antipsychotic-induced weight gain in chronic and first-episode psychotic disorders: a systematic critical reappraisal. CNS Drugs, 22(7), 547-562. doi:10.2165/00023210-200822070-00002
Andreasen, N. C., Carpenter, W. T., Jr., Kane, J. M., Lasser, R. A., Marder, S. R. et Weinberger, D. R. (2005). Remission in schizophrenia: proposed criteria and rationale for consensus. Am J Psychiatry, 162(3), 441-449. doi:10.1176/appi. ajp.162.3.441
Awad, A. G. (2021). The Search for a New Psychiatry: On Becoming a Psychiatrist, Clinical Neuroscientist and Other Fragments of Memory (iUniverse Ed.).
Barton, B. B., Segger, F., Fischer, K., Obermeier, M. et Musil, R. (2020). Update on weight-gain caused by antipsychotics: a systematic review and meta-analysis.Expert Opin Drug Saf, 19(3), 295-314. doi:10.1080/14740338.2020.1713091
Begemann, M. J. H., Thompson, I. A., Veling, W., Gangadin, S. S., Geraets, C. N. W., van ‘t Hag, E., … Sommer, I. E. C. (2020). To continue or not to continue? Antipsychotic medication maintenance versus dose-reduction/discontinuation in first episode psychosis: HAMLETT, a pragmatic multicenter single-blind randomized controlled trial. Trials, 21(1), 147. doi:10.1186/s13063-019-3822-5
Briki, M., Haffen, E., Monnin, J., Tio, G., Nicolier, M., Sechter, D. et Vandel, P. (2014). [Sexual dysfunction and depression: Validity of a French version of the ASEX scale]. Encephale, 40(2), 114-122. doi:10.1016/j. encep.2012.10.008
La psychopharmacologie des premiers épisodes psychotiques 133
Brunham, L. R., Ruel, I., Aljenedil, S., Riviere, J. B., Baass, A., Tu, J. V.,… Brophy, J. (2018). Canadian Cardiovascular Society Position Statement on Familial Hyper- cholesterolemia: Update 2018. Can J Cardiol, 34(12), 1553-1563. doi:10.1016/ j.cjca.2018.09.005
Carbon, M., Kapoor, S., Sheridan, E., Al-Jadiri, A., Azzo, S., Sarkaria, T., … Correll, C. U. (2015). Neuromotor Adverse Effects in 342 Youth During 12 Weeks of Naturalistic Treatment With 5 Second-Generation Antipsychotics. J Am Acad Child Adolesc Psychiatry, 54(9), 718-727 e713. doi:10.1016/j.jaac.2015.06.015
Carpenter, W. T., Jr., Heinrichs, D. W. et Alphs, L. D. (1985). Treatment of negative symptoms. Schizophr Bull, 11 (3), 440-452. doi:10.1093/schbul/11.3.440
Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, D. c. d. p. (2019). Guide d’utilisation de la clozapine. (ISBN : 978-2-550-85200-1). CIUSS de la Capitale-Nationale.
Chong, S. A., Ravichandran, N., Poon, L. Y., Soo, K. L. et Verma, S. (2006). Reducing polypharmacy through the introduction of a treatment algorithm : use of a treat- ment algorithm on the impact on polypharmacy. Ann Acad Med Singap, 35(7), 457-460. Retrieved from https://www.ncbi.nlm.nih.gov/pubmed/16902720
Crockford, D. et Addington, D. (2017). Canadian Schizophrenia Guidelines: Schizophrenia and Other Psychotic Disorders with Coexisting Substance Use Disorders. Can J Psychiatry, 62(9), 624-634. doi:10.1177/0706743717720196
Curtis, J., Watkins, A., Rosenbaum, S., Teasdale, S., Kalucy, M., Samaras, K. et Ward, P. B. (2016). Evaluating an individualized lifestyle and life skills intervention to prevent antipsychotic-induced weight gain in first-episode psychosis. Early Interv Psychiatry, 10(3), 267-276. doi:10.1111/eip.12230
Drake, R., Haddock, G., Tarrier, N., Bentall, R. et Lewis, S. (2007). The Psychotic Symptom Rating Scales (PSYRATS) : their usefulness and properties in first epi- sode psychosis. Schizophr Res, 89(1-3), 119-122. doi:10.1016/j.schres.2006.04.024
Edelsohn, G. A. (2019). Editorial : Making Use of What We Know : Medical Decision- Making and Antipsychotics. J Am Acad Child Adolesc Psychiatry, 58(11), 1051- 1053. doi:10.1016/j.jaac.2019.03.019
Frajerman, A., Morin, V., Chaumette, B., Kebir, O. et Krebs, M. O. (2020). [Management of cardiovascular co-morbidities in young patients with early onset psychosis : State of the art and therapeutic perspectives]. Encephale, 46(5), 390-398. doi:10.1016/j.encep.2020.03.007
Galletly, C., Castle, D., Dark, F., Humberstone, V., Jablensky, A., Killackey, E., … Tran, N. (2016). Royal Australian and New Zealand College of Psychiatrists clinical practice guidelines for the management of schizophrenia and related disorders. Aust N Z J Psychiatry, 50(5), 410-472. doi:10.1177/0004867416641195
Garcia-Amador, M., Merchan-Naranjo, J., Tapia, C., Moreno, C., Castro-Fornieles, J., Baeza, I., … Arango, C. (2015). Neurological Adverse Effects of Antipsychotics in Children and Adolescents. J Clin Psychopharmacol, 35(6), 686-693. doi:10.1097/ JCP.0000000000000419
Gomez-Revuelta, M., Pelayo-Teran, J. M., Juncal-Ruiz, M., Ortiz-Garcia de la Foz, V., Vazquez-Bourgon, J., Gonzalez-Pinto, A. et Crespo-Facorro, B. (2018). Long-Term Antipsychotic Effectiveness in First Episode of Psychosis : A 3-Year Follow-Up Randomized Clinical Trial Comparing Aripiprazole, Quetiapine,
134SantémentaleauQuébec,2021,XLVI,no 2
and Ziprasidone. Int J Neuropsychopharmacol, 21(12), 1090-1101. doi:10.1093/
ijnp/pyy082
Grigg, J., Worsley, R., Thew, C., Gurvich, C., Thomas, N. et Kulkarni, J. (2017). Antipsychotic-induced hyperprolactinemia : synthesis of world-wide guidelines and integrated recommendations for assessment, management and future research. Psychopharmacology (Berl), 234(22), 3279-3297.
doi :10.1007/s00213-017-4730-6
Haddad, P. M., Das, A., Keyhani, S. et Chaudhry, I. B. (2012). Antipsychotic drugs and extrapyramidal side effects in first episode psychosis: a systematic review of head-head comparisons. J Psychopharmacol, 26(5 Suppl), 15-26. doi:10.1177/0269881111424929
Haddock, G., McCarron, J., Tarrier, N. et Faragher, E. B. (1999). Scales to measure dimensions of hallucinations and delusions: the psychotic symptom rating scales (PSYRATS). Psychol Med, 29(4), 879-889. doi:10.1017/s0033291799008661
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., … Leucht, S. (2019). Comparative efficacy and tolerability of 32 oral anti- psychotics for the acute treatment of adults with multi-episode schizophrenia : a systematic review and network meta-analysis. Lancet, 394(10202), 939-951. doi:10.1016/S0140-6736 (19) 31135-3
Ivers, N. M., Jiang, M., Alloo, J., Singer, A., Ngui, D., Casey, C. G. et Yu, C. H. (2019). Diabetes Canada 2018 clinical practice guidelines: Key messages for family physicians caring for patients living with type 2 diabetes. Can Fam Physician, 65(1), 14-24. Retrieved from https://www.ncbi.nlm.nih.gov/pubmed/30674509
Iyer, S., Banks, N., Roy, M. A., Tibbo, P., Williams, R., Manchanda, R., … Malla, A. (2013a). A qualitative study of experiences with and perceptions regarding long- acting injectable antipsychotics: Part I-patient perspectives. Can J Psychiatry, 58(5 Suppl 1), 14S-22S. doi:10.1177/088740341305805s03
Iyer, S., Banks, N., Roy, M. A., Tibbo, P., Williams, R., Manchanda, R., … Malla, A. (2013b). A qualitative study of experiences with and perceptions regarding long-acting injectable antipsychotics: part II-physician perspectives. Can J Psychiatry, 58(5 Suppl 1), 23S-29S. doi:10.1177/088740341305805s04
Jordan, G., Lutgens, D., Joober, R., Lepage, M., Iyer, S. N. et Malla, A. (2014). The relative contribution of cognition and symptomatic remission to functional outcome following treatment of a first episode of psychosis. J Clin Psychiatry, 75(6), e566-572. doi:10.4088/JCP.13m08606
Kane, J. M., Schooler, N. R., Marcy, P., Correll, C. U., Achtyes, E. D., Gibbons, R. D. et Robinson, D. G. (2020). Effect of Long-Acting Injectable Antipsychotics vs Usual Care on Time to First Hospitalization in Early-Phase Schizophrenia: A Randomized Clinical Trial. JAMA Psychiatry. doi:10.1001/jamapsy- chiatry.2020.2076
Kay, S. R., Fiszbein, A. et Opler, L. A. (1987). The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull, 13(2), 261-276. doi:10.1093/ schbul/13.2.261
Keating, D., McWilliams, S., Boland, F., Doyle, R., Behan, C., Strawbridge, J. et Clarke, M. (2021). Prescribing pattern of antipsychotic medication for first- episode psychosis: a retrospective cohort study. BMJ Open, 11(1), e040387. doi:10.1136/bmjopen-2020-040387
La psychopharmacologie des premiers épisodes psychotiques 135
Kirson, N. Y., Weiden, P. J., Yermakov, S., Huang, W., Samuelson, T., Offord, S. J.,… Wong, B. J. (2013). Efficacy and effectiveness of depot versus oral antipsychotics in schizophrenia: synthesizing results across different research designs. J Clin Psychiatry, 74(6), 568-575. doi:10.4088/JCP.12r08167
Kishi, T., Ikuta, T., Matsui, Y., Inada, K., Matsuda, Y., Mishima, K. et Iwata, N. (2019). Effect of discontinuation v. maintenance of antipsychotic medication on relapse rates in patients with remitted/stable first-episode psychosis: a meta-analysis. Psychol Med, 49(5), 772-779. doi:10.1017/S0033291718001393
Kishimoto, T., Nitta, M., Borenstein, M., Kane, J. M. et Correll, C. U. (2013). Long- acting injectable versus oral antipsychotics in schizophrenia: a systematic review and meta-analysis of mirror-image studies. J Clin Psychiatry, 74(10), 957-965. doi:10.4088/JCP.13r08440
Kishimoto, T., Robenzadeh, A., Leucht, C., Leucht, S., Watanabe, K., Mimura, M., … Correll, C. U. (2014). Long-acting injectable vs oral antipsychotics for relapse prevention in schizophrenia: a meta-analysis of randomized trials. Schizophr Bull, 40(1), 192-213. doi:10.1093/schbul/sbs150
Lally, J., Ajnakina, O., Stubbs, B., Williams, H. R., Colizzi, M., Carra, E., … Gaughran, F. (2017). Hyperprolactinaemia in first episode psychosis—A longitudinal assess- ment. Schizophr Res, 189, 117-125. doi:10.1016/j.schres.2017.07.037
Lally, J. et Gaughran, F. (2019). Treatment resistant schizophrenia—review and a call to action. Ir J Psychol Med, 36(4), 279-291. doi:10.1017/ipm.2018.47
Lambert, M., Conus, P., Eide, P., Mass, R., Karow, A., Moritz, S., … Naber, D. (2004). Impact of present and past antipsychotic side effects on attitude toward typical antipsychotic treatment and adherence. Eur Psychiatry, 19(7), 415-422. doi:10.1016/j.eurpsy.2004.06.031
Leclerc, L. D., Demers, M. F., Bardell, A., Bilodeau, I., Williams, R., Tibbo, P. et Roy, M. A. (2021). A Chart Audit Study of Clozapine Utilization in Early Psychosis. J Clin Psychopharmacol. doi:10.1097/JCP.0000000000001384
Lindenmayer, J. P., Glick, I. D., Talreja, H. et Underriner, M. (2020). Persistent Barriers to the Use of Long-Acting Injectable Antipsychotics for the Treatment of Schizophrenia. J Clin Psychopharmacol, 40(4), 346-349. doi:10.1097/ JCP.0000000000001225
Mizrahi, R., Rusjan, P., Agid, O., Graff, A., Mamo, D. C., Zipursky, R. B. et Kapur, S. (2007). Adverse subjective experience with antipsychotics and its relationship to striatal and extrastriatal D2 receptors: a PET study in schizophrenia. Am J Psychiatry, 164(4), 630-637. doi:10.1176/ajp.2007.164.4.630
Ormerod, S., McDowell, S. E., Coleman, J. J. et Ferner, R. E. (2008). Ethnic dif- ferences in the risks of adverse reactions to drugs used in the treatment of psychoses and depression: a systematic review and meta-analysis. Drug Saf, 31(7), 597-607. doi:10.2165/00002018-200831070-00005
Potvin, S., Aubin, G. et Stip, E. (2015). Antipsychotic-induced parkinsonism is asso- ciated with working memory deficits in schizophrenia-spectrum disorders. Eur Arch Psychiatry Clin Neurosci, 265(2), 147-154. doi:10.1007/s00406-014-0511-y
Procyshyn, R. M., Bezchlibnyk-Butler, K. Z., Jeffries, J. .J. (2019). Clinical handbook of psychotropic drugs. (23rd ed. ed.). Hogrefe Publishing.
136 Santé mentale au Québec, 2021, XLVI, no 2
Robinson, D., Woerner, M. G., Alvir, J. M., Bilder, R., Goldman, R., Geisler, S., … Lieberman, J. A. (1999). Predictors of relapse following response from a first episode of schizophrenia or schizoaffective disorder. Arch Gen Psychiatry, 56(3), 241-247. doi:10.1001/archpsyc.56.3.241
Shea, S. C. (2017). Psychiatric interviewing, 3rd Edition. The art of understanding : a practical guide for psychiatrists, psychologists, counselors, social workers, nurses and other mental health professionals. Elsevier.
Shymko, G., Grace, T., Jolly, N., Dobson, L., Hacking, D., Parmar, A., … Waters, F. (2021). Weight gain and metabolic screening in young people with early psychosis on long acting injectable antipsychotic medication (aripiprazole vs paliperidone). Early Interv Psychiatry, 15(4), 787-793. doi:10.1111/eip.13013
Stip, E. (2017). Cost Reductions Associated With Long-Acting Injectable Antipsycho- tics According to Patient Age. J Clin Psychiatry, 78(8), e1061. doi:10.4088/ JCP.16lr11402
Stip, E., Abdel-Baki, A., Roy, M. A., Bloom, D. et Grignon, S. (2019). [Long-acting antipsychotics: The QAAPAPLE algorithm review]. Can J Psychiatry, 64(10), 697-707. doi:10.1177/0706743719847193
Stip, E., Grignon, S., Roy, M. A., Bloom, D., Osman, O., Amiri, L.,… Arnone, D. (2020). From QAAPAPLE 1 to QAAPAPLE 2: how do we move from one algorithm to another one with Long Acting Antipsychotics (LAIs). Expert Rev Neurother, 20(12), 1325-1332. doi:10.1080/14737175.2020.1826930
Subotnik, K. L., Casaus, L. R., Ventura, J., Luo, J. S., Hellemann, G. S., Gretchen- Doorly, D., … Nuechterlein, K. H. (2015). Long-Acting Injectable Risperidone for Relapse Prevention and Control of Breakthrough Symptoms After a Recent First Episode of Schizophrenia. A Randomized Clinical Trial. JAMA Psychiatry, 72(8), 822-829. doi:10.1001/jamapsychiatry.2015.0270
Taipale, H., Solmi, M., Lähteenvuo, M., Tanskanen, A., Correll, C. U. et Tiihonen, J. (2021). Antipsychotic use and risk of breast cancer in women with schi- zophrenia: a nationwide nested case-control study in Finland. The lancet. Psychiatry, 8(10), 883-891. doi:https://doi.org/10.1016/S2215-0366 (21) 00241-8
Takeuchi, H., Siu, C., Remington, G., Fervaha, G., Zipursky, R. B., Foussias, G. et Agid, O. (2019). Does relapse contribute to treatment resistance ? Antipsychotic response in first- vs. second-episode schizophrenia. Neuropsychopharmacology, 44(6), 1036-1042. doi:10.1038/s41386-018-0278-3
Taylor, D., Paton, S. et Kapur, S. (2015). The Maudsley Prescribing Guidelines in Psychiatry (12th ed.). Wiley Blackwell.
Teff, K. L., Rickels, M. R., Grudziak, J., Fuller, C., Nguyen, H. L. et Rickels, K. (2013). Antipsychotic-induced insulin resistance and postprandial hormonal dysregulation independent of weight gain or psychiatric disease. Diabetes, 62(9), 3232-3240. doi:10.2337/db13-0430
Tiihonen, J., Haukka, J., Taylor, M., Haddad, P. M., Patel, M. X. et Korhonen, P. (2011). A nationwide cohort study of oral and depot antipsychotics after first hospitalization for schizophrenia. Am J Psychiatry, 168(6), 603-609. doi:10.1176/ appi.ajp.2011.10081224
Velligan, D. I., Sajatovic, M., Hatch, A., Kramata, P. et Docherty, J. P. (2017). Why do psychiatric patients stop antipsychotic medication? A systematic review of
La psychopharmacologie des premiers épisodes psychotiques 137 reasons for nonadherence to medication in patients with serious mental illness.
Patient Prefer Adherence, 11, 449-468. doi:10.2147/PPA.S124658
Weiden, P. J., Roma, R. S., Velligan, D. I., Alphs, L., DiChiara, M. et Davidson, B. (2015). The challenge of offering long-acting antipsychotic therapies : a prelimi- nary discourse analysis of psychiatrist recommendations for injectable therapy to patients with schizophrenia. J Clin Psychiatry, 76(6), 684-690. doi:10.4088/ JCP.13m08946
Williams, R., Malla, A., Roy, M. A., Joober, R., Manchanda, R., Tibbo, P., … Agid, O. (2017). What Is the Place of Clozapine in the Treatment of Early Psychosis in Canada ? Can J Psychiatry, 62(2), 109-114. doi:10.1177/0706743716651049
Witt, K., van Dorn, R. et Fazel, S. (2013). Risk factors for violence in psychosis: systematic review and meta-regression analysis of 110 studies. PLoS One, 8(2), e55942. doi:10.1371/journal.pone.0055942
Wu, H. E. et Okusaga, O. O. (2015). Antipsychotic medication-induced dysphoria: its meaning, association with typical vs. atypical medications and impact on adherence. Psychiatr Q, 86(2), 199-205. doi:10.1007/s11126-014-9319-1
Wunderink, L., Nieboer, R. M., Wiersma, D., Sytema, S. et Nienhuis, F. J. (2013). Recovery in remitted first-episode psychosis at 7 years of follow-up of an early dose reduction/discontinuation or maintenance treatment strategy: long-term follow-up of a 2-year randomized clinical trial. JAMA Psychiatry, 70(9), 913-920. doi:10.1001/jamapsychiatry.2013.19
Zhu, Y., Li, C., Huhn, M., Rothe, P., Krause, M., Bighelli, I., … Leucht, S. (2017). How well do patients with a first episode of schizophrenia respond to antipsychotics : A systematic review and meta-analysis. Eur Neuropsychopharmacol, 27 (9), 835-844. doi:10.1016/j.euroneuro.2017.06.011





